本文原创,未经同意请勿转载
解读新规
浦东新区进口非特殊用途化妆品备案管理制度
2017年1月,国家食品药品监督管理总局发布了2017年第7、10号公告,公布了传闻已久的进口非特殊用途化妆品备案试点办法(下称“浦东制度”)。现将其中几大重点问题解读如下:
一、与现行备案制度有何区别?
现行备案制度:在华责任单位备案→产品检测→国家局评审→取得批文→进口销售。
浦东制度:在华责任单位备案→产品检测→上海局备案→网备成功→进口销售→资料实质审查。
可以看出,最大的区别在于“浦东制度”采取了检测完成后快速网备(目前看来仅进行形式审查)后,先放行产品进口,后期(三个月内)再进行备案资料的实质审查,这样直接的结果是使产品能够进口的同时进行审批,“提前”进入市场。
另一个重要的区别在于:“浦东制度”没有纸质的批文,只有电子版备案信息凭证。
二、有哪些产品可以通过“浦东制度”进口?
作为“试点”,自然是有着一定的范围限制,根据“第7号公告”可以看出,共有三个要求:1、“从上海市浦东新区口岸进口”;2、“境内责任人注册地在上海浦东新区”;3、“首次进口非特殊用途化妆品”。以上三条只要有一条不符合的,就需要根据“现行备案制度”申报批文。当然,如果按照“现行备案制度”取得了批文,那么在浦东口岸进口也是没有问题的。
三、需要准备的资料有变化吗?
增加了“境外生产企业生产质量管理的相关证明材料”,“现行备案制度”中,只有涉及到境外委托加工关系的情况需要提供加工企业的ISO或GMP。“现行备案制度”需要提交的资料点此处。
四、“境内责任人”与“在华申报责任单位”不一样?
确实不一样,不仅是名字不一样,实质责任也不一样了。
“现行备案制度”中的“在华申报责任单位”仅要求:负责申报有关进口化妆品行政许可事宜(参见“国食药监保化[2011]428号”)。而“浦东制度”中“境内责任人”则明确要求:“负责产品的进口和经营,并依法承担相应的产品质量安全责任”。
五、具体流程是怎样的?
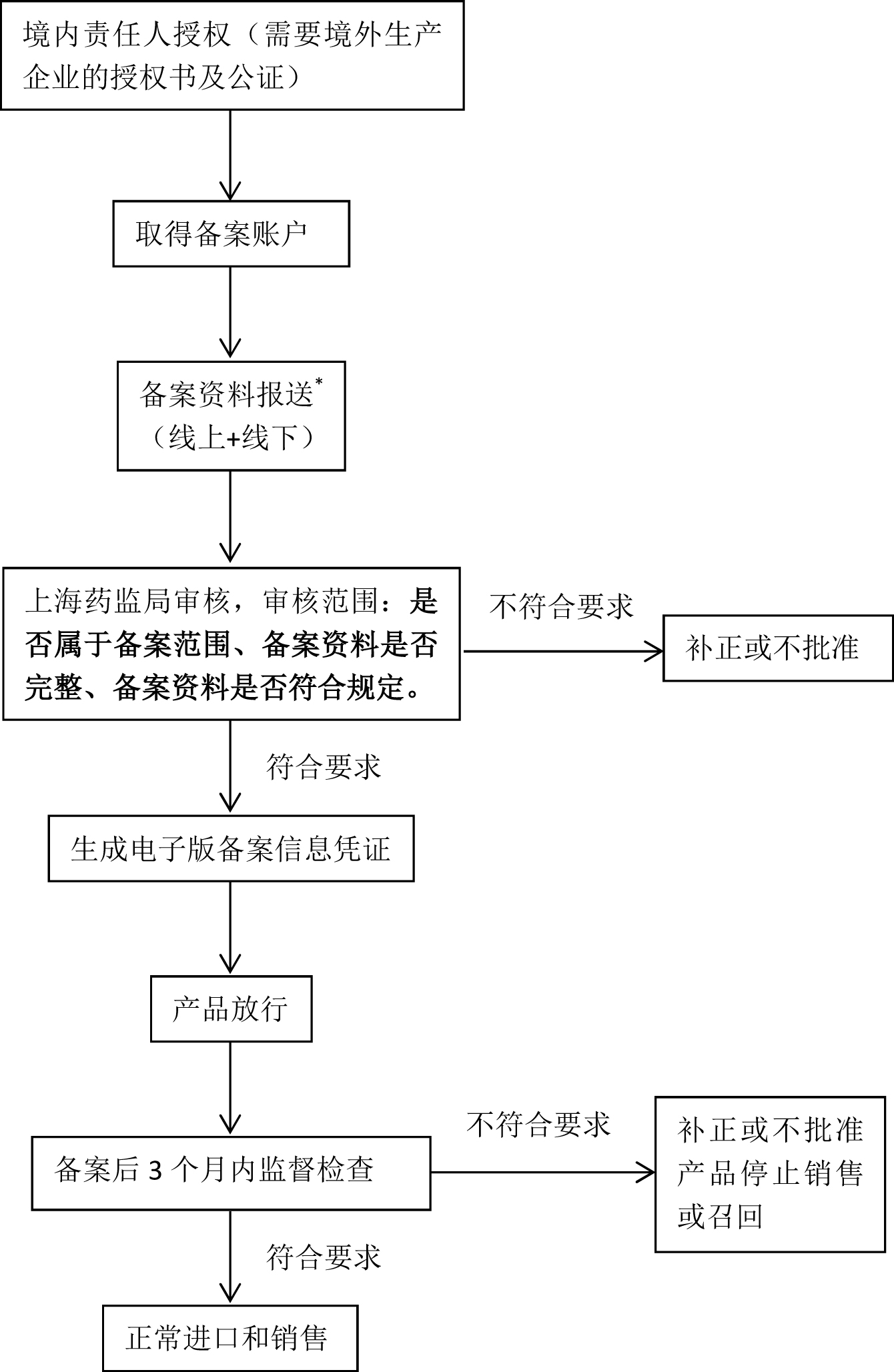
*备案资料报送中的资料如下:
(一)进口非特殊用途化妆品备案申请表(在线填报);
(二)产品中文名称命名依据(在线填报);
(三)产品配方(在线填报);
(四)产品质量安全控制要求;
(五)产品原包装(含产品标签、产品说明书)图片;拟专为中国市场设计包装的,需同时提交产品设计包装(含产品标签、产品说明书);
(六)产品生产工艺简述;
(七)产品技术要求;
(八)化妆品行政许可检验机构出具的检验报告及相关资料;
(九)产品中可能存在安全性风险物质的有关安全性评估资料;
(十)化妆品适用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书;
(十一)产品在生产国(地区)或原产国(地区)生产和销售的证明文件;
(十二)境外生产企业生产质量管理的相关证明材料;
(十三)参照《化妆品行政许可申报受理规定》(国食药监许〔2009〕856号,以下称《申报受理规定》)要求,可能有助于备案的其他资料。
此次政策的试点必然有利于加快产品的进口速度,但目前阶段,新制度的实施情况,评审尺度如何,后期监管力度都还是未知数,仍需进一步观察。
如有任何疑问,可联系思悦咨询张洋洋
电话:18310589226
QQ:506275388
原帖链接:关于在上海市浦东新区试点实施进口非特殊用途化妆品备案管理有关事宜的公告(2017年第7号)
总局关于发布上海市浦东新区进口非特殊用途化妆品备案管理工作程序(暂行)的公告(2017年第10号)


